Dãy điện hóa của kim loại – Tóm tắt lý thuyết và cách nhớ nhanh – Tự Học 365
Dãy điện hóa của kim loại – Tóm tắt lý thuyết và cách nhớ nhanh
1. Cặp oxi hoá – khử của kim loại
USD A { { g } ^ { + } } + 1 e \ rightleftarrows Ag USD
USD C { { u } ^ { 2 + } } + 2 e \ rightleftarrows Cu USD
USD \ underbrace { F { { e } ^ { 2 + } } } _ { \ left [ O \ right ] } + 2 e \ rightleftarrows \ underbrace { Fe } _ { \ left [ K \ right ] } USD
♦Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá – khử của kim loại.
Thí dụ : Cặp oxi hoá – khử Ag + / Ag ; Cu2 + / Cu ; Fe2 + / Fe
2. So sánh tính chất của các cặp oxi hoá – khử
Thí dụ : So sánh đặc thù của hai cặp oxi hoá – khử Cu2 + / Cu và Ag + / Ag .
Cu + 2A g + → Cu2 + + 2A g
Kết luận : Tính khử : Cu > Ag
Tính oxi hoá : Ag + > Cu2 +
3. Dãy điện hoá của kim loại là gì?

4. Ý nghĩa dãy điện hoá của kim loại
♦ Dự đoán chiều của phản ứng oxi hoá – khử theo quy tắc α : Phản ứng giữa hai cặp oxi hoá – khử sẽ xảy ra theo chiều chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn, sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn .
♦ Thí dụ : Phản ứng giữa hai cặp Fe2 + / Fe và Cu2 + / Cu xảy ra theo chiều ion Cu2 + oxi hoá Fe tạo ra ion Fe2 + và Cu .
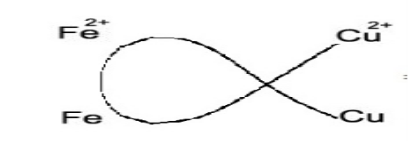
Fe + Cu2 + → Fe2 + + Cu
♦ Tổng quát : Giả sử có 2 cặp oxi hoá – khử Xx + / X và Yy + / Y ( cặp Xx + / X đứng trước cặp Yy + / Y )
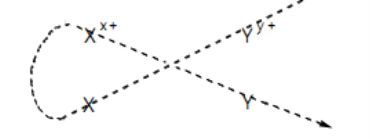
♦ Phương trình phản ứng:
Yy + + X → Xx + + Y
5. Pin điện hoá là gì?
a. Cấu tạo của pin điện hóa
♦ Mô tả cấu trúc của pin điện hóa : Là 1 thiết bị gồm : 2 lá sắt kẽm kim loại, mỗi lá được nhúng vào 1 dd muối có chứa cation của sắt kẽm kim loại đó ; 2 dd này được nối với nhau bằng 1 cầu muối ( dd điện li trơ : NH4NO3, KNO3 )
♦ Suất điện động của pin điện hoá ( vd : Zn – Cu )
Epin = 1,10 V
b. Giải thích
♦ Điện cực Zn ( cực âm ) là nguồn phân phối e, Zn bị oxi hoá thành Zn2 + tan vào dung dịch : Zn → Zn2 + + 2 e
♦ Điện cực Cu ( cực dương ) những e đến cực Cu, ở đây những ion Cu2 + bị khử thành sắt kẽm kim loại Cu bám trên mặt phẳng lá đồng .
Cu2 + + 2 e → Cu
♦ Vai trò của cầu muối : Trung hòa điện tích của 2 dung dịch
√ Cation NH4 + ( hoặc K + ) và Zn2 + chuyển dời sang cốc đựng dung dịch CuSO4
√ trái lại : những anion NO3 – và SO42 – chuyển dời sang cốc đựng dung dịch ZnSO4 .
Sự vận động và di chuyển của những ion này làm cho những dung dịch muối luôn trung hoà điện .
♦ Phương trình ion rút gọn trình diễn quy trình oxi hoá-khử xảy ra trên mặt phẳng những điện cực của pin điện hoá :
Cu2 + + Zn → Cu + Zn2 +
Oxh Kh Kh. yếu Oxh yếu
USD \ frac { Z { { n } ^ { 2 + } } } { Zn } \ \ \ \ \ frac { C { { u } ^ { 2 + } } } { Cu } USD
c. Nhận xét
♦ Có sự biến hóa nồng độ những ion Cu2 + và Zn2 + trong quy trình hoạt động giải trí của pin. Cu2 + giảm, Zn2 + tăng
♦ Năng lượng của phản ứng oxi hóa – khử trong pin điện hóa đã sinh ra dòng điện một chiều .
Source: https://hanoittfc.com.vn
Category: Tin Tức






